吴南 柴小翠
在水产养殖中,常见饲料引起肠黏膜的慢性炎症,同时肠黏膜免疫屏障也经常是水产病源(如病毒、细菌等)入侵的首当其冲的位置。因此,对鱼类肠炎的研究已经成为水产疾病的研究热点。目前,斑马鱼已经成为肠粘膜免疫研究的常见模式动物,应用于疾病建模以及药物筛选。
中国科学院水生生物研究所鱼类功能基因组学学科组的研究人员,开发了一套简单快速的斑马鱼肠黏膜免疫细胞悬液的制备方法,用于制备来自斑马鱼肠粘膜的免疫细胞悬液。通过反复吹打,可将肠绒毛肌层以上部分的免疫细胞分离出来(图1)。吹打法对于脆弱的斑马鱼黏膜组织,可规避经济鱼常用的网搓法对于细胞活性的损失,细胞结团率较低,细胞活性大幅提高。
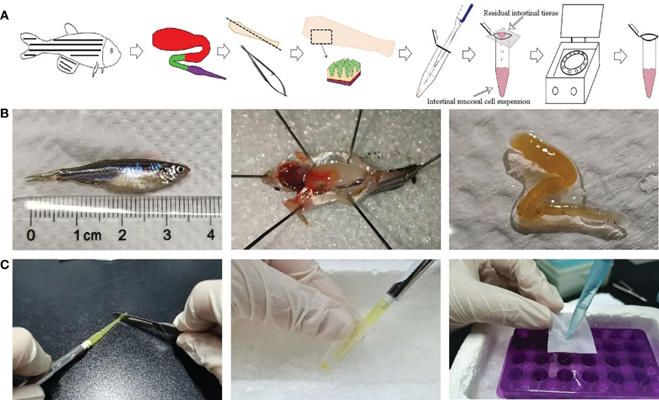
图1 斑马鱼肠粘膜免疫细胞悬液制备的操作图解
qPCR和转录组分析结果表明,分离细胞组的免疫细胞标记基因表达量显著高于肠组织本身,而MUC基因表达热图也表明在分离细胞组优势表达的为内层黏蛋白基因;功能富集分析也在分离细胞组中发现大量免疫相关通路(图2)。本方法是对于斑马鱼肠黏膜炎症模型的有效技术补充,可更好地在细胞水平探究斑马鱼肠黏膜免疫代谢的机理。本研究中单细胞悬液制备、转录组测序及数据分析由分析测试中心提供技术支撑。相关研究成果以 “The manipulation of cells suspension from zebrafish intestinal mucosa contributes to understanding enteritis”为题发表于Frontiers in Immunology,原文链接:
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1193977/full。

图2 肠粘膜免疫细胞相关基因功能富集分析及热图
该团队通过豆粕诱导肠炎(SBMIE)建模、分子病理学(包括免疫荧光和免疫细胞成像)、基因表达(qPCR和转录组学),以及菌群结构分析(16s rRNA测序)等方法,阐明了SOCS8通过抑制碳水化合物代谢,在鱼类肠粘膜和肝脏组织中发挥分别发挥粘膜保护和免疫调节的作用。qPCR和转录组分析结果表明:在豆粕组中,促炎/抗炎细胞因子、免疫细胞分化相关基因的表达量在野生型的升高,却在SOCS8敲除突变体中被抑制;细胞凋亡相关基因在SOCS8敲除突变体中表达量升高,表明突变体肠粘膜免疫屏障功能出现障碍。突变体应对粘膜炎症的反应失调,6月龄即出现肠组织早衰。
此外,16s rRNA扩增子分析表明,突变体肠道中拟杆菌丰度升高,暗示肠道内的微生物组已适应宿主因SOCS8缺失引起的碳水化合物代谢水平升高;而免疫调节相关的疣微菌丰度较低,也呼应了SOCS8敲除引起的肠黏膜组织形态的病理改变(图3)。本研究发现鱼类SOCS8作为免疫调节因子,参与了代谢性炎症中免疫和代谢两个方面的调控,特别是控制了肠粘膜中细胞因子的释放、免疫细胞分化/募集,以及通过肠肝轴来调控代谢和肠道微生物多样性。
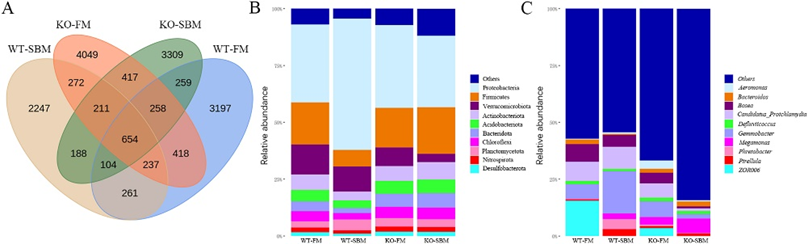
图3 SOCS8敲除对SBMIE肠道微生物组成和丰度变化的影响
本研究中转录组测序、16s rRNA测序及数据分析服务由分析测试中心提供技术支撑。相关研究成果以 “The immunoregulatory role of fish specific type II SOCS via inhibiting metaflammation in the gut-liver axis”为题发表在Water Biology and Security,原文链接:https://www.sciencedirect.com/science/article/pii/S2772735122001718#fig2。
致谢:感谢中国科学院水生生物研究所鱼类功能基因组学学科组吴南副研究员对此文的支持!