藻类细胞和合成生物学

学科带头人:黄开耀 研究员
学科组成员:龙欢博士;邓璇硕士;博士生: 繆荣丽;硕士生:曾辉、王坤、徐泽东、张俊、孙慧芳
学科组介绍
现代生物学的发展使人们对真核细胞细胞器的结构和功能有了进一步的认识,但是对于由成百上千的蛋白和脂类组成的细胞器的形成和解聚,特别是与其生理功能的关系所知甚少,本实验室以纤毛和油滴这两类细胞器作为模型来研究细胞器形成和解聚的细胞生物学与分子生物学机理,以利于纤毛病的诊断和治疗以及利用油滴来制造生物能源。
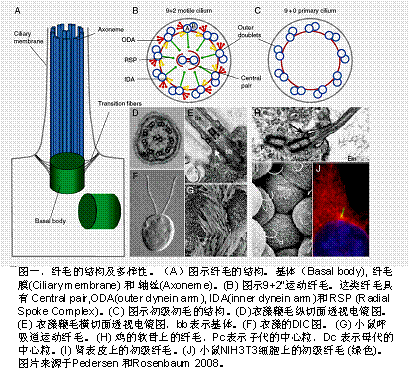 |
纤毛 /鞭毛是突出在真核细胞表面由微管组成的细胞器,执行着重要的运动和感受功能 (图一 )。其病变能导致多囊肾、神经系统发育缺陷、眼盲、耳聋、肥胖病、雄性不育等多种纤毛病。由于纤毛是一类在进化上很保守的细胞器,因而研究纤毛的模式生物包括单细胞衣藻、线虫、斑马鱼和小鼠等,其中衣藻鞭毛的形成和解聚不仅与细胞周期相关,而且还可通过外界环境诱导;加上衣藻易于培养,能分离到大量的鞭毛用于生化分析;能像酵母一样进行遗传分析和突变体的筛选;又利于直接用显微镜观察鞭毛内蛋白的运动,因此,衣藻是研究纤毛的首选模式生物,本课题组将利用衣藻,结合斑马鱼和动物细胞系来研究以下几个方面的内容:
1. 鞭毛膜的形成和降解
鞭毛膜的形成和稳定是鞭毛执行其运动和感受功能的前提。我们的研究目标就是解析鞭毛膜蛋白从高尔基到鞭毛, 然后由鞭毛分泌到细胞外的分子机理,将研究起源于高尔基的小囊泡定向运输到鞭毛/纤毛底部;鞭毛和细胞体之间的扩散屏障;鞭毛膜蛋白的分布及运动;小囊泡从鞭毛分泌到细胞外和小囊泡分泌的生物学功能。
2. 鞭毛或纤毛的解聚
鞭毛/纤毛的形成和解聚是相互联系的。我们以前的工作表明泛素结合系统与鞭毛/纤毛的解聚有关,在阐明泛素结合系统在鞭毛去组装中的作用机理的基础上,我们将通过筛选和分析鞭毛解聚的突变体,寻找新的控制鞭毛解聚的蛋白。同时研究运动纤毛和初级纤毛解聚的异同点,初步解析初级纤毛的形成、解聚与细胞周期的关系。
3. 纤毛病的诊断及药物的筛选
与人类纤毛形成与解聚有关的基因突变后可导致纤毛病,我们将这些基因作为靶点,通过高通量测序分析其突变来诊断纤毛病。我们将利用衣藻的鞭毛、斑马鱼的突变体以及动物细胞系筛选天然和人工合成的小分子库,以寻找治疗纤毛病的药物。
油滴广泛分布在植物的种子和动物的脂肪细胞中。它是由单层磷脂组成,内含中性三酰甘油。在动物细胞中其形成和解聚与肥胖症有关。植物油滴中的中性脂是食用油和制备生物柴油的原料。我们的长期目标是利用几种不同的绿藻的优势来研究油滴的生物合成和生物降解, 并利用这些知识来改造现有的绿藻生产生物柴油。与目前用来生产生物柴油的大豆等相比,绿藻在生长过程中需水量少、不占用耕地、能直接固定空气中的二氧化碳。我们的研究内容包括:
1. 利用衣藻来研究油滴形成和解聚的分子机理和代谢调控网络
作为研究鞭毛和光合作用的模式生物,衣藻的转化,遗传分析等技术最成熟,而且衣藻细胞在缺氮的条件下能形成油滴,在添加氮源后油滴解聚。我们将利用质粒插入诱变的方法来筛选油滴形成和解聚的突变体,找出在这个过程中起调控作用的基因。同时利用Micro RNA 技术来阻断糖代谢和极性脂的合成途径,以到达促进中性脂积累的目的。
2. 利用小球藻来研究微藻细胞周期的调控
目前微藻能源的一个瓶颈是细胞生长太慢,达不到产业化所需的生物量,而目前所知小球藻生长周期最短,我们将为小球藻建立遗传转化体系,研究其细胞周期调控的机理,为利用遗传工程的方法提高微藻的生长速度打下基础。
 |
3. 利用葡萄藻来研究微藻分泌油滴的分子机理
有些绿藻像葡萄藻,其含油量高达细胞干重的百分之七十,而且在特定的条件下能将油滴分泌到细胞外(图二)。如果能收集分泌在培养基中的油滴,就可以大大简化微藻能源下游工程。但葡萄藻生长速度慢,我们的设想是利用葡萄藻研究其油滴分泌的分子机理,然后利用合成生物学的方法将它嫁接到生长快的小球藻中,以降低微藻能源产业化的成本。
近期发表论文
1. Huang K., Tsao C., 2010, Importin-β2: a key to two gates? 2010, Protein&Cell 1(9):791-792. (Huang K is corresponding author)
2. Huang K., Diener D., Rosenbaum J., 2009, The ubiquitin conjugation system is involved in the disassembly of cilia/flagella. Journal of Cell Biology, 186:601-613.
3. Huang K., Diener D., Mitchell A., Pazour G., Witman G., Rosenbaum J., 2007, Function and dynamics of PKD2 in Chlamydomonas flagella. Journal of Cell Biology, 179:501-514.
4. Soon Im C., Eberhard S., Huang K., Beck C., Grossman A., 2006. Phototropin involvement in expression of genes encoding chlorophyll and carotenoid biosynthesis enzymes and LHC apoproteins in Chlamydomonas reinhardtii. Plant Journal 48(1):1-16.
5. Huang K., Kunkel T., Beck. C. F., 2004. Localization of blue-light receptor phototropin to the flagella of the green alga Chlamydomonas reinhardtii. Mol. Biol. Cell. 15(8):3605-3614.
6. Huang K., Beck C.F., 2003. Phototropin is the blue-light receptor that controls multiple steps in the sexual life cycle of the green alga Chlamydomonas reinhardtii. Proc. Natl. Acad. Sci. USA. 100:6269-6274.
