水生所揭示自闭症相关蛋白POGZ抑制2C基因和逆转录转座元件
神经发育障碍疾病(如自闭症和儿童多动症)的发病率在世界范围内呈现不断攀升的趋势。其中,中国青少年自闭症患者比例高达20%,并以每年20万的速度增长,严重影响家庭幸福(Sun et al., 2020, Nat. Commun.)。基因组测序研究表明,自闭症是一种高异质性遗传发育疾病。根据个体遗传背景的不同,患者表现出不同程度的神经系统功能异常,如智力、语言、运动行为缺陷等。但是,由于目前缺乏对疾病病因的深入认知,临床上尚无有效的治疗手段。
内源性逆转录病毒(endogenous retrovirus, ERV)是转座子的一种,来源于亿万年前感染宿主细胞的逆转录病毒。在某些特殊情况下,逆转录病毒侵入宿主的生殖细胞,然后随着生殖细胞传到后代。经过数百万年的进化,这种逆转录病毒就演变成了ERV,在基因组中保留了下来。长期以来,ERV被认为是基因组上的垃圾序列,在宿主表观遗传机制的作用下处于沉默状态。然而最近的研究表明,在胚胎发育早期,ERV呈现动态的变化,并在胚胎发育中有重要的功能。比如,精子与卵子结合形成受精卵之后,通过卵裂发育到2细胞期并开始合子基因组激活,而激活的转录本就包括内源性逆转录病毒MERVL。在正常生理条件下,ERV的表达受到严格的时空调节。由于遗传或者环境因素导致的ERV异常激活可能会产生严重的后果。值得注意的是,ERV异常激活与神经发育障碍疾病的发生和进展密切相关。
POGZ是突变频率最高的自闭症易感基因之一, 编码一个含锌指、着丝粒蛋白B DNA结合域以及转座酶来源DDE等多种功能域的转录因子。前期研究发现,POGZ蛋白作为染色质调节因子,对维持胚胎干细胞的稳定性起重要作用(Sun et al., 2022, Mol. Autism)。然而,其具体的作用机制仍不清楚。近日,利用小鼠胚胎干细胞为模型,中国科学院水生生物研究所孙玉华研究员团队揭示了POGZ通过调节内源性逆转录病毒在胚胎干细胞稳定性维持以及神经发育和疾病发生中的关键作用。
研究发现,在POGZ缺失的胚胎干细胞中,2细胞期相关基因(Zscan4、MERVL等)的表达显著上调,同时,POGZ缺失导致约50种左右ERV(IAPEY、IAPEZ等)的表达异常上调,提示POGZ在转录水平抑制这些2C基因以及重复序列的表达。重要的是,在胚胎干细胞向神经诱导分化的过程中,POGZ缺失导致神经发育基因表达紊乱以及神经前体细胞形成缺陷,伴随着IAPEY元件的异常激活。

图1 POGZ缺失导致干细胞中2细胞期相关基因(Zscan4、Duxf3等)的表达显著上调(A-B)以及IAPEy元件的激活(C)
机制上,POGZ一方面直接结合和抑制2C细胞期关键基因Dux的表达;另一方面通过与异染色质机器复合体中的SETDB1和TRIM28互作,招募它们催化和维持抑制性组蛋白修饰H3K9me3,使ERVs处于沉默状态。POGZ缺失后,ERV与临近基因形成嵌合转录本,并处于异常激活的状态。鉴于ERV异常激活和神经发育障碍疾病的密切关系,该研究成果为POGZ突变的发病机制提供了新的重要理论依据,对治疗相关疾病的药物研发提供了新思路。
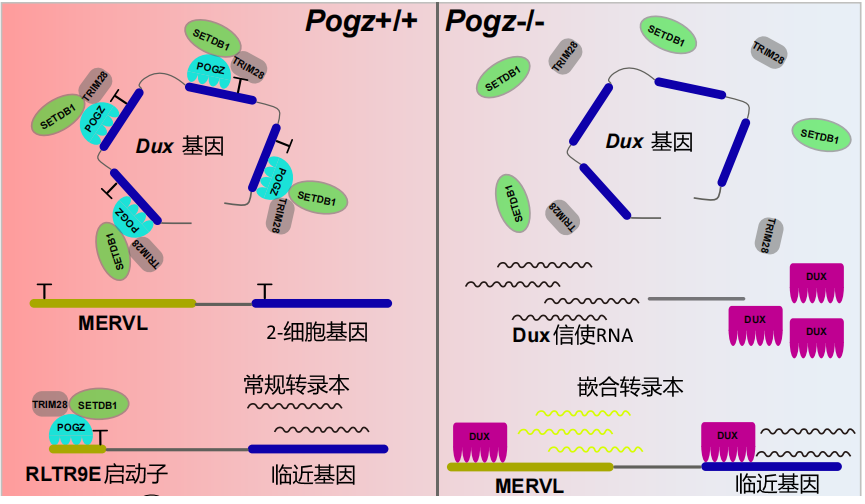
图2 POGZ抑制2C基因以及逆转录转座元件的模式图
该研究于近日发表于Cell子刊Cell Reports上https://www.sciencedirect.com/science/article/pii/S2211124723008781?via%3Dihub。水生所孙晓云和武汉大学医学研究院的张天喆为该论文的共同第一作者,孙玉华研究员为通讯作者。该研究得到了国家重点研发项目、国家自然科学基金面上项目等基金的资助。
参考文献:
Sun XY, Zhang TZ, Cheng LX, Tong B, Jiang W, Sun YH* (2023). POGZ suppresses 2C transcriptional program and retrotransposable elements. Cell Reports. DOI: 10.1016/j.celrep.2023.112867
Sun XY, Cheng LX, Sun YH* (2022). Autism-related protein POGZ regulates ESC and ESC neural induction. Molecular Autism. 13: 24. https://doi.org/10.1186/s13229-022-00502-9
Sun XY, XX Peng, YQ Cao, Y Zhou and YH Sun* (2020). ADNP promotes neural differentiation by modulating Wnt/β-catenin signaling. Nature Communications, 11: 1984
