水生所研究发现宿主细胞中感知细菌分子的重要因子
机体为了有效抵御病原体的入侵,并同时避免在静息状态时,免疫应答的激活带来非必要能量消耗和组织炎症损伤,宿主细胞发展出精密的病原体识别系统,对病原相关分子模式进行特异性识别,进而启动级联信号传导。该机制不仅能精确区分“自我”与“非我”成分,还可通过负反馈调节信号传导,动态控制炎症反应强度,从而在有效抗感染的同时规避能量消耗或组织炎症损伤风险。
中国科学院水生生物研究所肖武汉团队在研究工作中发现:人源OCEL1基因无法在大肠杆菌中表达,而鼠源Ocel1基因在大肠杆菌中能够高量表达。氨基酸序列比对显示:人源OCEL1蛋白比鼠源Ocel1蛋白在N端多30个氨基酸(从66位至96位);缺失这30个氨基酸的人源OCEL1基因能够在大肠杆菌中高量表达。他们进一步通过截短分析发现:在这30个氨基酸组成的短肽中,具有回文结构、并富含脯氨酸的6氨基酸元件(-PPGPGPP-)(被命名为:Palindromic Proline-rich Element,PPE)对于人源OCEL1蛋白在细菌中的降解至关重要,特别是第81位和第82位的脯氨酸。这两个脯氨酸的任一突变,都可使人源OCEL1蛋白在细菌中稳定表达。他们通过质谱分析,鉴定到细菌FKBP家族脯氨酸异构酶特异性靶向人源OCEL1蛋白的PPE元件,导致其在细菌中的不稳定和在宿主细胞中的泛素化降解。
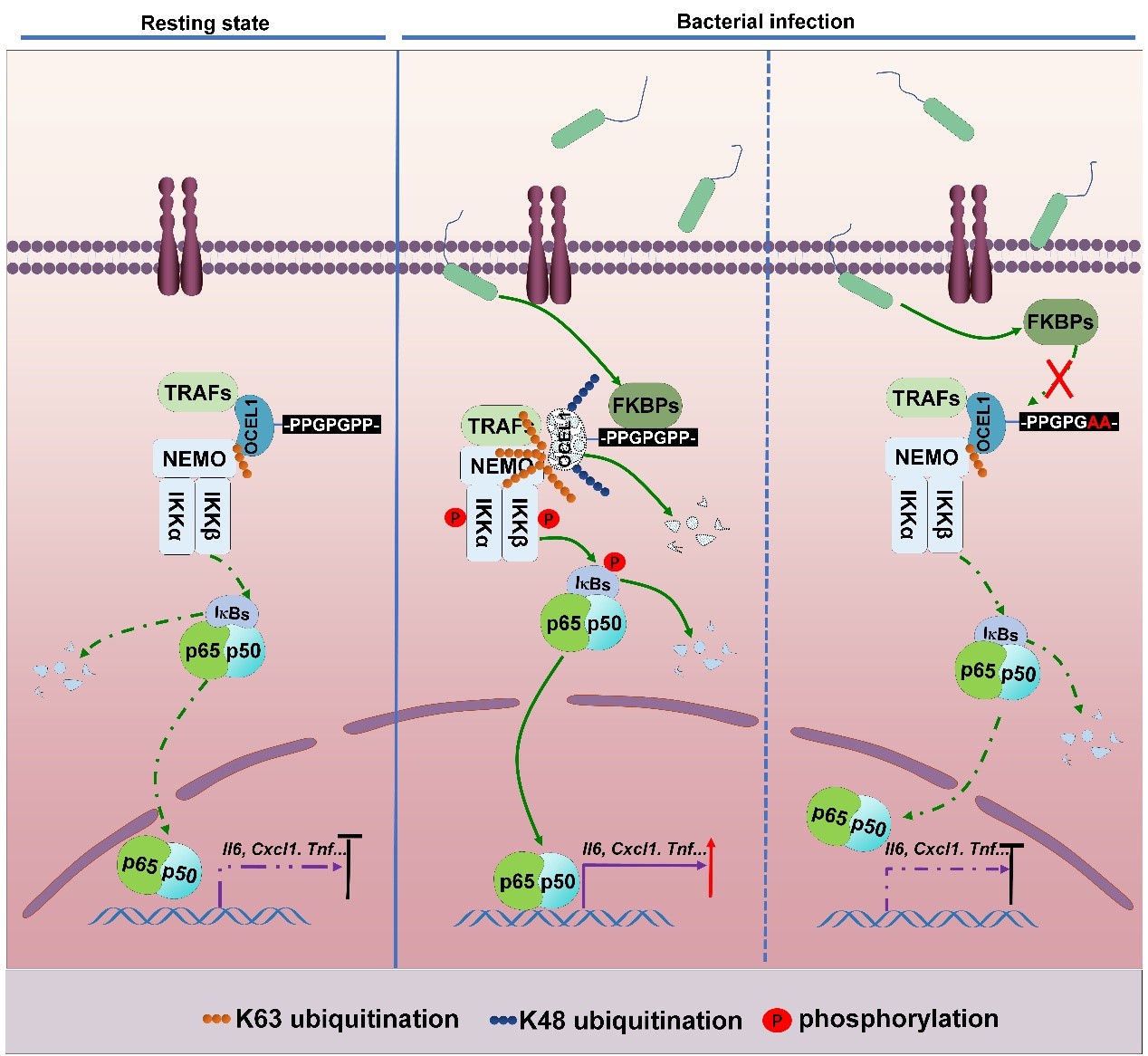
研究团队对于宿主细胞中这一特异细菌感知因子的生物学功能进行了深入的剖析。在宿主细胞中,过表达OCEL1能显著抑制LPS或病原菌(PAO1)诱导的细胞炎症因子的表达,如:IL-1β,IL-6,TNF等;相反,在宿主细胞中敲降或敲除OCEL1后能显著增强LPS或病原菌诱导的细胞炎症因子的表达。Ocel1缺失小鼠也表现出对LPS和病原菌刺激的过度炎症反应和显著增高的死亡率。分子机制解析发现,OCEL1能与NF-kB信号通路中的调节因子——NEMO的LZ结构域特异性结合,抑制E3泛素连接酶TRAF6介导的K63位连接的多聚泛素化,从而抑制NF-kB信号通路,这表明OCEL1是NF-kB信号通路的一个负调控因子。
为了进一步验证人源OCEL1的在体(In vivo)生物学功能,研究团队制备了野生型OCEL1人源化小鼠和OCEL1第81/82位脯氨酸突变的人源化小鼠(P81/82A)。当人工感染野生型病原菌(PAO1)时,机体的炎症反应和死亡率呈现出:从Ocel1缺失小鼠→野生型OCEL1人源化小鼠→突变型OCEL1(P81/82A)人源化小鼠逐步减轻或降低的趋势。然而,当人工感染5个FKBP家族脯氨酸异构酶全部缺失的病原菌(PAO1Δ5)时,机体炎症反应和死亡率呈现出:野生型OCEL1人源化小鼠与突变型OCEL1(P81/82A)人源化小鼠的表型相似,都显著轻于或低于Ocel1缺失小鼠的表型。这进一步通过在体(In vivo)证据证实了:细菌FKBP家族脯氨酸异构酶特异性靶向人源OCEL1的PPE元件,降解OCEL1,启动NF-kB信号通路驱动的炎症反应。
该研究鉴定到一个宿主细胞中感知细菌侵袭的重要因子。在静息状态时,该因子犹如一把锁,牢牢锁定NF-kB信号通路,避免机体炎症反应的发生;然而,当病原菌侵袭时,细菌FKBP家族脯氨酸异构酶进入宿主细胞,特异性靶向OCEL1的PPE元件,导致OCEL1的泛素化降解,解除OCEL1对NF-kB信号通路的锁闭功能,启动炎症反应。
12月 19 日,相关研究成果以 “Human OCEL1 senses bacterial infection to unlock inflammatory responses”为题在线发表在《科学免疫学》(Science Immunology)上。李智博士和王晶副研究员为论文的共同第一作者,肖武汉研究员为通讯作者。团队其他成员、中国科学院武汉病毒所周卫博士和陈士云研究员提供了技术支持,澳大利亚昆士南大学Katryn J Stacey教授在论文写作上提供了帮助。该研究得到了国家自然科学基金重点项目和中国科学院战略性先导专项A资助。
