水生所发现去泛素化酶OTUD3在分别调控抗RNA病毒和抗DNA病毒先天免疫信号通路中发挥完全相反的作用
先天免疫(Innate immunity)是机体抵御病原微生物入侵的第一道防线,它从无脊椎动物到脊椎动物都非常保守。机体通过模式识别受体(PRRs),如Toll样受体、RIG-I样受体、细胞质DNA传感器等,识别病原体相关分子模式(PAMPs),即病毒感染或复制过程中产生的RNA和DNA,启动机体免疫反应,诱导I型干扰素、炎症因子和其他下游抗病毒效应蛋白的产生。鱼类隶属于原始有颌类脊椎动物,其获得性免疫(Adaptive Immunity)相对欠发达,免疫记忆相对较弱,因此,先天免疫对于鱼类抗病毒感染尤为重要。阐明鱼类抗病毒先天免疫的遗传机制,对培育抗病毒鱼类新品种具有重要指导意义。
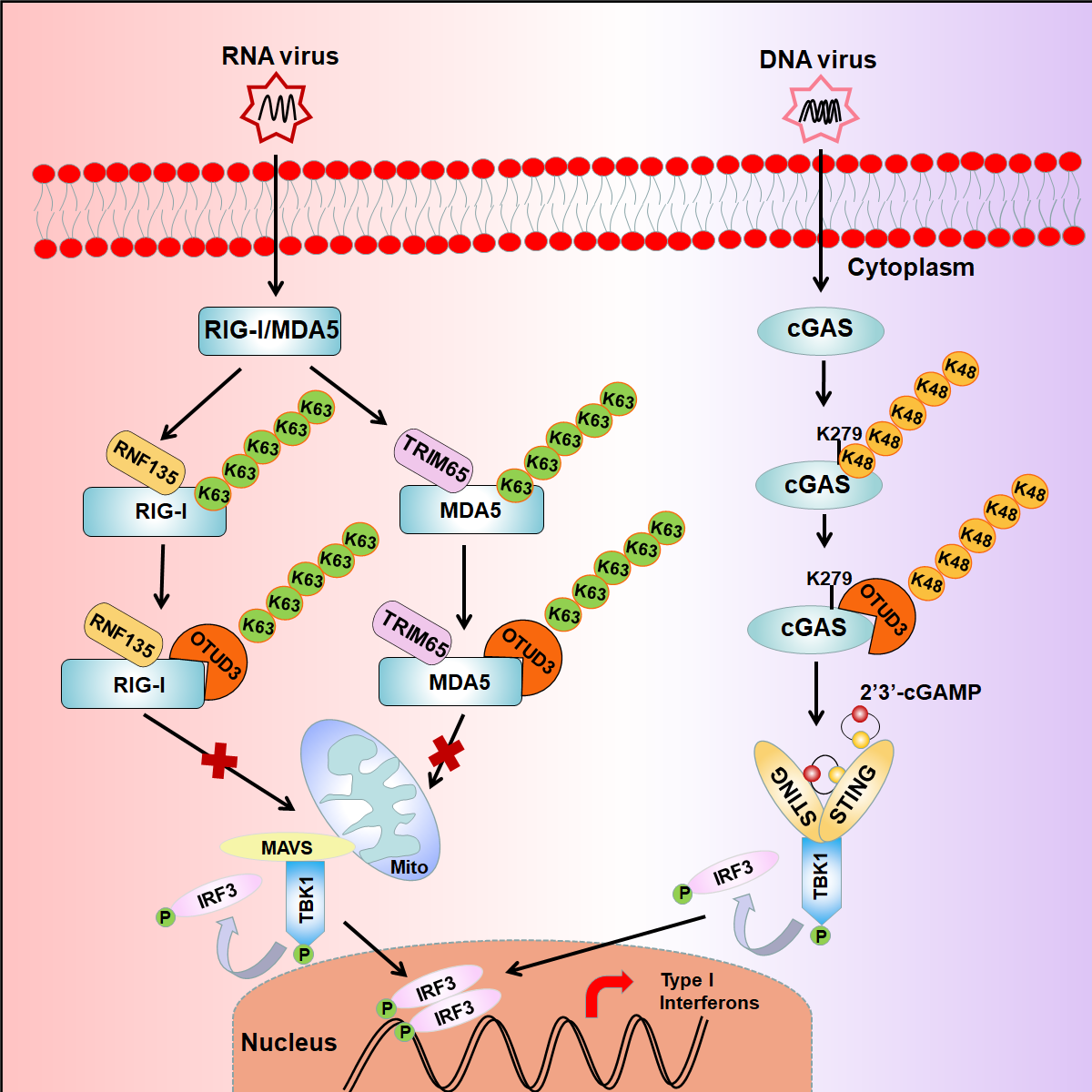
在模式识别受体中,Toll样受体3(TLR3)主要识别细胞外和细胞内的病毒RNA,而细胞质病毒RNA主要由RIG-I样受体识别,细胞质病毒DNA则主要由cGAS/STING识别。RIG-I样受体包括RIG-I和MDA5,当其与病毒RNA结合后发生构象变化,并招募PP1α/γ进行去磷酸化,进而由多个E3泛素连接酶,如TRIM25、TRIM65、RNF135等,介导其发生K63位连接的多聚泛素化,激活先天免疫信号通路。cGAS是一个环磷酸鸟苷-腺苷合成酶,当cGAS与病毒DNA结合后,介导合成第二信使cGAMP。cGAMP再与内质网(ER)上的膜蛋白干扰素基因刺激因子(STING)结合,并活化STING,激活先天免疫信号通路。cGAS的活性同样也受到蛋白修饰的调节。
近日,中国科学院水生生物研究所肖武汉研究员团队在Cell Reports发表了题为“Opposing effects of deubiquitinase OTUD3 in innate immunity against RNA and DNA viruses”的研究论文,阐明了去泛素化酶OTUD3在分别调控抗RNA病毒和抗DNA病毒先天免疫信号通路中发挥完全相反的作用。
为了寻找抗RNA病毒先天免疫信号通路的负调控因子,科研人员系统筛选了去除RIG-I样受体K63位连接多聚泛素化的去泛素化酶。研究发现:去泛素化酶OTUD3既能靶向RIG-I,也能靶向MDA5,并去除它们K63位连接的多聚泛素化。进一步分析发现:OTUD3能去除由RNF135介导的RIG-I的 K63位连接多聚泛素化,以及由TRIM65介导的MDA5 的K63位连接多聚泛素化。此外,OTUD3还能抑制RIG-I和MDA5的多聚化,以及它们与病毒RNA的结合。科研人员利用CRISPR/Cas9技术,获得了OTUD3敲除的斑马鱼和小鼠。在斑马鱼中,经鲤春病毒(SVCV)(RNA病毒)攻毒实验发现:otud3缺失斑马鱼与野生型斑马鱼相比,其体内的干扰素水平和抗病毒基因表达显著上升,病毒的复制受到抑制;otud3缺失的斑马鱼表现出更强的抗鲤春病毒感染的能力。在小鼠中,经水疱性口炎病毒(VSV)(RNA病毒)攻毒试验发现:Otud3缺失小鼠与野生型小鼠相比,其体内的干扰素水平和抗病毒基因表达显著上升,病毒的复制受到抑制;Otud3缺失小鼠表现出更强的抗水疱性口炎病毒感染的能力。
更为有趣的是,OTUD3还能正向调控由cGAS介导的抗DNA病毒先天免疫信号通路。经深入分析,OTUD3可特异性去除cGAS第279位赖氨酸上K48位连接的多聚泛素化,进而稳定cGAS蛋白,促进cGAS与病毒DNA的结合,激活抗DNA病毒先天免疫反应。在斑马鱼中,经鲤疱疹病毒(CyHV-2)(DNA病毒)攻毒实验发现:otud3缺失斑马鱼与野生型斑马鱼相比,其体内的干扰素水平下降;otud3缺失斑马鱼表现出对鲤疱疹病毒的易感性增加。在小鼠中,经单纯疱疹病毒(HSV-1)(DNA病毒)攻毒实验发现:Otud3缺失小鼠与野生型小鼠相比,其体内的干扰素水平显著下降;Otud3缺失小鼠表现出对单纯疱疹病毒的易感性增加。该研究揭示了同一个基因在分别调控抗RNA病毒和抗DNA病毒先天免疫信号通路中的相反作用。
肖武汉研究员为该论文的通讯作者,博士后蔡孝廉为该论文的第一作者。该研究得到中科院战略先导专项A、国家自然科学基金重点项目、国家自然科学基金创新群体项目和国家重点研发计划“蓝色粮仓”项目的资助。
