水生所揭示线粒体动态调控鱼类生殖干祖细胞命运决定的新机制
生殖细胞是多细胞动物体内唯一能够传递遗传信息的载体,是物种延续和品种扩繁的基础。对于有性生殖的动物而言,其生命诞生起始于精子与卵子的结合。无论精子或者卵子,均来源于胚胎期的原始生殖细胞(Primordial germ cells, PGCs)和幼体或成体性腺中的生殖干细胞(germline stem cells,GSCs),即生殖干祖细胞(germline stem and progenitor cells,GSPCs)。GSPCs的自我更新和分化是配子发生和性腺分化的关键,对这一机制开展创新性研究,不仅是发育生物学和生殖生物学的重要命题,而且是种业创新的重大需求。
线粒体被称为细胞的“动力工厂”,通过有氧呼吸和氧化磷酸化产生三磷酸腺苷(ATP),为细胞活动提供能量。线粒体是高度动态的细胞器,不断进行融合(fusion)和分裂(fission)形成动态平衡,这对于线粒体稳态及其功能发挥至关重要。已有研究表明,线粒体稳态参与调控干细胞的命运维持和分化。然而,是否存在着GSPCs特异的线粒体动态调控机制,以及线粒体动态是如何作用于GSPCs的命运决定,尚不清楚。
中国科学院水生生物研究所孙永华团队长期从事鱼类生殖细胞发育相关研究,揭示了调控鱼类性腺发育和配子发生的多个新因子及其作用机制(He et al. 2020; Zhang et al. 2020b; Wang et al. 2022; Xie et al. 2022),并建立了同种或异种GSPC移植借腹生殖技术(Zhang et al. 2020a; Zhang et al. 2022)。最近,孙永华团队与华中农业大学陈振夏团队以斑马鱼为模型,通过生物信息学挖掘和实验生物学验证,发现了一个在生殖细胞中特异表达的线粒体融合调控因子Pld6。Pld6的缺失导致生殖细胞中线粒体动态失衡,线粒体形态及功能发生严重缺陷,进一步导致GSPCs命运的维持和分化受阻,最终形成缺乏生殖细胞的空巢精巢。这一研究揭示了生殖细胞特异的线粒体融合事件对于生殖细胞命运决定的重要作用,为鱼类生殖细胞发育的调控机制提供了新的见解。
研究者首先对性腺分化阶段的精卵巢进行转录组分析,发现线粒体组装以及氧化磷酸化相关基因在卵巢中的转录水平显著高于精巢,提示GSPCs向卵子的分化需要更强的线粒体供能。进一步通过对精卵巢的单细胞转录组分析发现,调控线粒体融合的关键因子pld6不仅在卵巢组织高表达,而且特异表达于包括GSPCs在内的生殖细胞中(图1)。
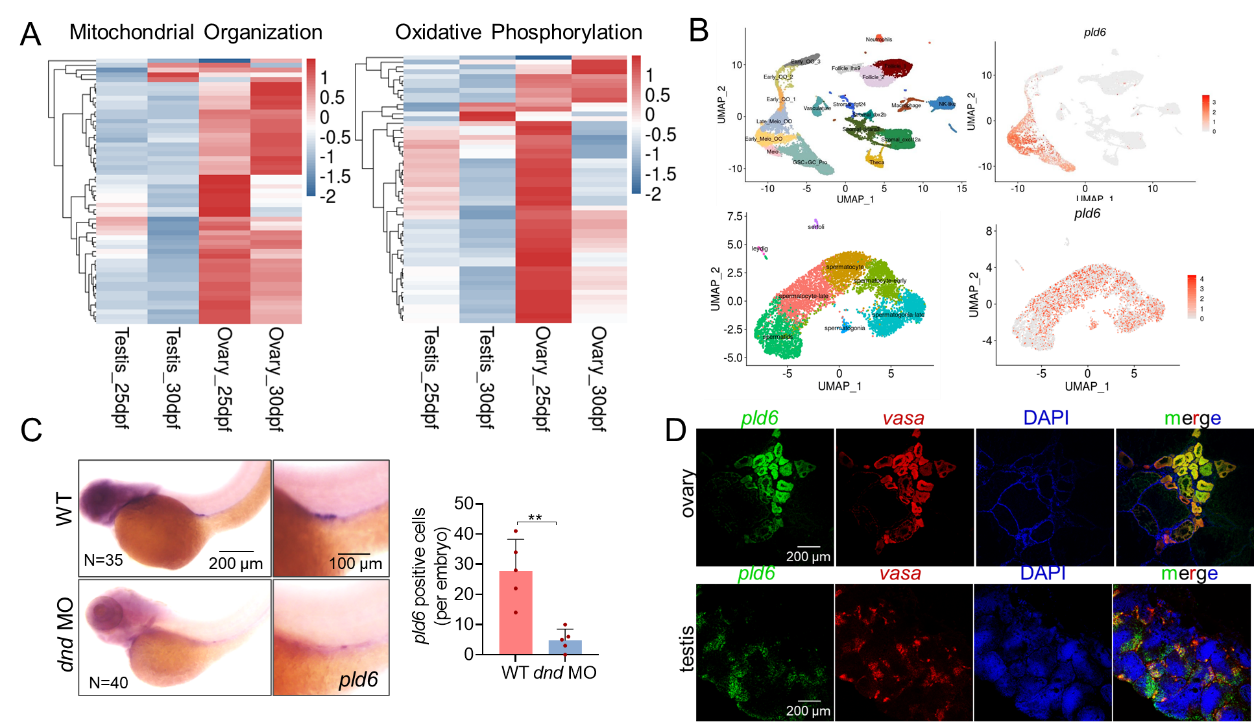
图1 发现线粒体融合调控因子pld6特异表达于生殖细胞谱系
随后,研究者建立pld6缺失的斑马鱼突变体模型,结果纯合突变体全部发育为不可育的雄性,组织学和细胞生物学研究显示纯合突变体性腺中的生殖细胞完全丢失。对突变性腺的发育进行时序追踪和研究,发现pld6缺失的GSPCs既无法通过有丝分裂进行增殖,也无法通过减数分裂进行分化,从而在性腺发育早期即走向细胞凋亡途径。进一步研究揭示,突变体GSPCs中线粒体动态失衡,线粒体拷贝数以及ATP合成均显著减少,同时生殖细胞中特有的线粒体云(mitochondria-nuage)在突变体GSPCs中缺失,进而导致piRNA的合成受阻(图2)。因此,该研究发现一个新的特异存在于生殖细胞中的线粒体融合调控因子,并揭示了其调控了鱼类GSPCs命运维持与分化的分子和细胞学机制。
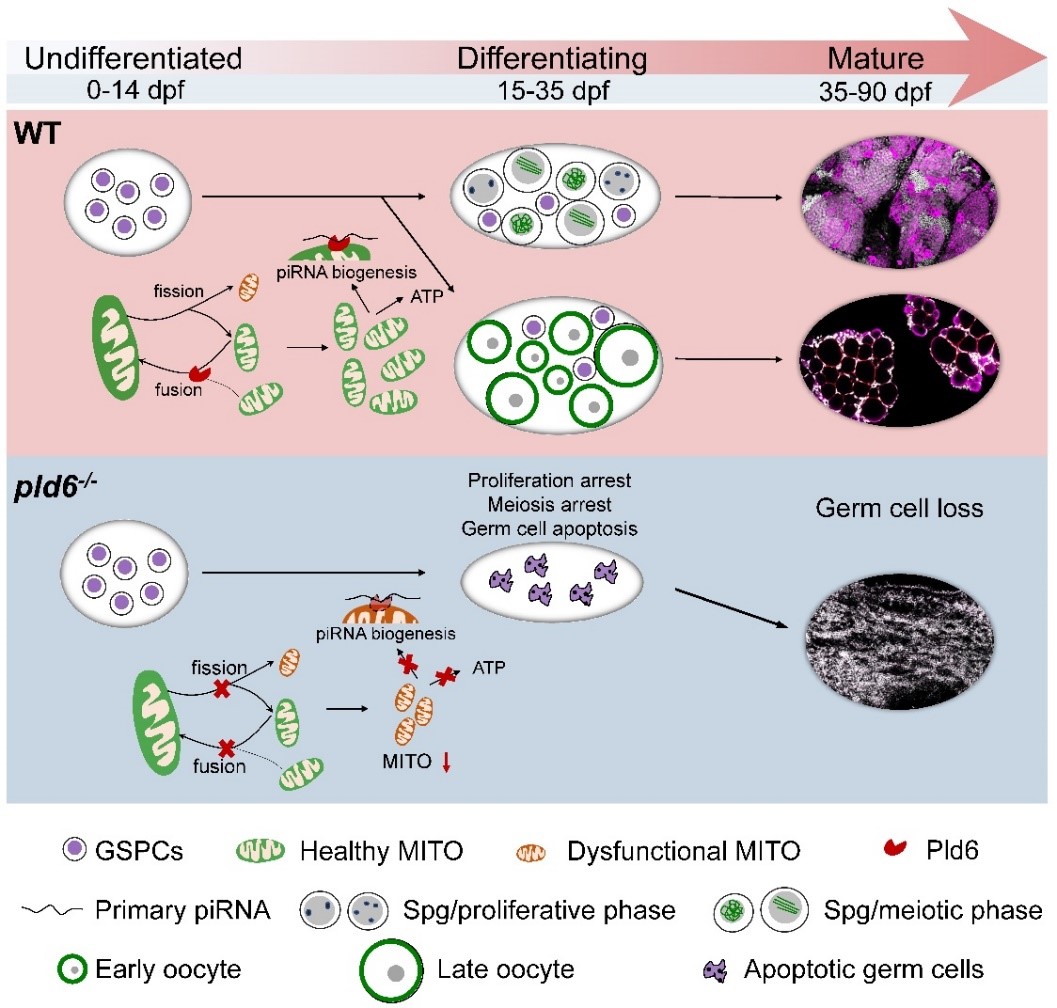
图2 Pld6通过调节线粒体动态调控生殖干祖细胞命运维持与分化的作用机制
该研究近日以“一个生殖细胞特异的线粒体融合因子调控生殖干祖细胞的维持与分化”为题,在线发表于国际学术期刊Advanced Science。水生所鱼类发育与生物技术学科组张茹博士和华中农业大学博士生涂懿璇为该文并列第一作者,水生所孙永华研究员是该文通讯作者,华中农业大学陈振夏教授为共同通讯作者。水生所叶鼎副研究员和复旦大学粤港澳大湾区精准医学研究院顾正龙教授参与研究。该研究得到国家杰出青年科学基金、国家自然科学基金创新研究群体、国家重点研发计划、中国科学院战略性先导科技专项等资助。文中构建的pld6突变体已保藏至国家水生生物种质资源库国家斑马鱼资源中心。
全文链接:https://doi.org/10.1002/advs.202203631
相关文献:
He M, Zhang R, Jiao S, Zhang F, Ye D, Wang H, Sun Y. 2020. Nanog safeguards early embryogenesis against global activation of maternal β-catenin activity by interfering with TCF factors. PLOS Biology 18: e3000561.
Wang Y, Ye D, Zhang F, Zhang R, Zhu J, Wang H, He M, Sun Y. 2022. Cyp11a2 Is Essential for Oocyte Development and Spermatogonial Stem Cell Differentiation in Zebrafish. Endocrinology 163. bqab258
Xie H, Wang X, Jin M, Li L, Zhu J, Kang Y, Chen Z, Sun Y, Zhao C. 2022. Cilia regulate meiotic recombination in zebrafish. Journal of Molecular Cell Biology doi:10.1093/jmcb/mjac049.
Zhang F, Hao Y, Li X, Li Y, Ye D, Zhang R, Wang X, He M, Wang H, Zhu Z et al. 2022. Surrogate production of genome-edited sperm from a different subfamily by spermatogonial stem cell transplantation. Science China Life sciences 65: 969-987.
Zhang F, Li X, He M, Ye D, Xiong F, Amin G, Zhu Z, Sun Y. 2020a. Efficient generation of zebrafish maternal-zygotic mutants through transplantation of ectopically induced and Cas9/gRNA targeted primordial germ cells. Journal of Genetics and Genomics 47: 37-47.
Zhang Q, Ye D, Wang H, Wang Y, Hu W, Sun Y. 2020b. Zebrafish cyp11c1 Knockout Reveals the Roles of 11-ketotestosterone and Cortisol in Sexual Development and Reproduction. Endocrinology 161: bqaa048.
